Pierwsza zasada termodynamiki
Brzmienie pierwszej zasady termodynamiki jest następujące:
Zmiana energii wewnętrznej układu \(\Delta U\) termodynamicznego jest równa zmianie ilości ciepła \(Q\) pobranego lub oddanego przez układ i pracy \(W\) wykonanej nad układem przez siły zewnętrzne lub pracy wykonanej przez układ nad otoczeniem.
Wzór na pierwszą zasadę termodynamiki można więc zapisać:
gdzie:
- \(\Delta U=U_{stan\ końcowy} - U_{stan\ początkowy} - zmiana energii wewnętrznej.
- \(Q\) - ilość ciepła pobranego lub oddanego przez układ.
- \(W\) - praca sił zewnętrznych wykonana przez siły zewnętrzne nad układem lub praca wykonana przez układ nad otoczeniem.
Uwaga na znaki Q i W
Stosując wzór na pierwszą zasadę termodynamiki w zadaniach lub innych rozważaniach należy pamiętać o odpowiednich znakach dla wartości Q i W.
- jeżeli ciało pobiera ciepło z otoczenia, to Q ma znak dodatni (Q>0).
- jeżeli ciało oddaje ciepło do otoczenia, to Q ma znak ujemny (Q<0).
- jeżeli to siły zewnętrzne wykonują pracę nad układem, to W ma znak dodatni (W>0).
- jeżeli to układ wykonuje pracę nad otoczeniem, to wówczas W ma znak ujemny (W<0).
I zasada termodynamiki - sformułowanie równoważne
Oto równoważne sformułowanie pierwszej zasady termodynamiki:
Nie istnieje perpetuum mobile pierwszego rodzaju.
Co to jest perpetuum mobile I rodzaju? Napiszemy o tym w osobnym artykule, natomiast tu zasygnalizujemy jedynie, że jest to maszyna (silnik), który wykonuje pracę przez nieskończenie długi czas bez pobierania energii z zewnątrz.

W zapisie różniczkowym 1 zasada termodynamiki wygląda następująco:
\(dU=dQ+dW\)
Przykład 1
Gdy prasujemy koszulkę za pomocą żelazka, energia wewnętrzna koszulki rośnie w wyniku ciepła Q dostarczanego materiałowi i w wyniku tarcia poprzez pocieranie. Zarówno Q jak i W mają dodatnią wartość (Q>0 i W>0), zatem ΔU=Q+W>0. Jeżeli znamy wartości Q i W, można je podstawić do wzoru i wyliczyć przyrost energii wewnętrznej.
Przykład 2
Gdy włożymy szklankę wody do lodówki na pewien czas, to ciepło z układu szklanka-woda zostaje oddane do otoczenia lodówki, a więc Q<0. W tym przypadku żadna praca nie jest wykonywania, więc W=0. Mamy więc ΔU=Q+0<0.
Przykład 3
Gdy postawimy garnuszek wody na kuchence gazowej na pewien czas, to ciepło z płomienia zostaje przekazywane do układu garnuszek-woda, a więc Q>0. W tym przypadku żadna praca nie jest wykonywania, więc W=0. Mamy więc ΔU=Q+0>0.
Przykład 4
Przy pocieraniu rąk o siebie zwiększamy ich energię wewnętrzną. Wykonujemy tu dodatnią pracę W (W>0) i nie mamy w ogóle do czynienia z dostarczaniem ciepła do układu dwóch rąk z zewnatrz (Q=0). Więc ΔU=W+0=W>0.
Praca objętościowa
Często posługujemy się pojęciem pracy objętościowej lub pracą sił ciśnienia dla gazów zamkniętym w tłoku. Pojęcie te stosuje się przy omawianiu procesów termodynamicznych.
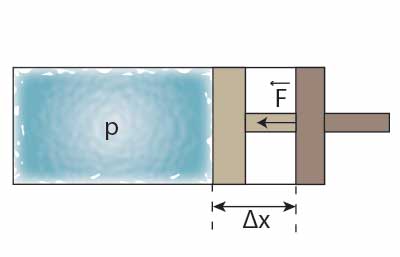
Jeżeli mamy gaz zamknięty w szczelnym tłoku, to praca wykonana przez siłę zewnętrzną \(F\) przy niewielkim przesunięciu tłoka o \(\Delta x\) tak, aby ciśnienie \(p\) w jego wnętrzu pozostawało stałe, wyliczymy ze wzoru:
W powyższym wyprowadzeniu skorzystano ze wzoru na ciśnienie \(p=\frac{F}{S}\), czyli \(F=pS\) oraz z definicji objętości walca lub prostopadłościanu, jakim może być cylinder (pole podstawy \(S\) pomnożone przez wysokość \(\Delta x\)).
Znak minus oznacza tyle, że gdy siły zewnętrzne wykonują pracę nad gazem przez tłok (sprężanie gazu), to objętość gazu maleje.
Ciekawostki
Pierwsza zasada termodynamiki wyraża zasadę zachowania energii dla wszystkich procesów termodynamicznych. Co ciekawe, to właśnie pierwsza zasada termodynamiki doprowadziła naukowców do odkrycia zasady zachowania energii, a nie odwrotnie.

Pytania
Jak można dostarczyć ciepło do układu?
Ciepło może być wymieniane z układem na kilka sposobów, na przykład poprzez:
- zetknięcie z innym ciałem,
- promieniowanie cieplne.
© medianauka.pl, 2021-04-12, A-4018
Data aktualizacji artykułu: 2025-04-23

 Druga zasada termodynamiki
Druga zasada termodynamiki Trzecia zasada termodynamiki
Trzecia zasada termodynamiki Perpetuum mobile
Perpetuum mobile Ciepło
Ciepło Energia wewnętrzna
Energia wewnętrzna Zerowa zasada termodynamiki
Zerowa zasada termodynamiki