Układ okresowy
*
**
Zaznacz wybrany pierwiastek
Symbol:
Liczba atomowa:
Masa atomowa:
Okres:
Grupa:
Blok:
Charakter chemiczny:
Stan skupienia:
Wartościowość:
Elektroujemność:
Rozmieszczenie elektronów:
Konfiguracja elektronowa:
Promień atomu:
Rok odkrycia:
Temp. topnienia:
Temp. wrzenia:
Tablica Mendelejewa
Układ okresowy pierwiastków, tablica Mendelejewa jest to uporządkowane zestawienie wszystkich pierwiastków chemicznych. Pierwiastki chemiczne są tu uporządkowane według rosnącej liczby atomowej. Liczba atomowa określa liczbę protonów w jądrze atomu. Określa także liczbę elektronów w atomie w stanie obojętnym. To kluczowa wielkość określająca właściwości chemiczne danego pierwiastka. Liczba ta jest jednocześnie kolejnym numerem pierwiastka w tym uporządkowaniu.
Elektrony w atomach są umiejscowione na kolejnych powłokach o ściśle określonej maksymalnej liczbę elektronów, jaka może się na nich zmieścić. Kolejne powłoki są zajmowane przez elektrony dopiero po całkowitym zapełnieniu powłok o mniejszej energii. Zjawisko to wynika z zakazu Pauliego. Na jednym orbitalu mogą znajdować się najwyżej dwa elektrony o rożnym spinie. Elektrony powłoki walencyjnej (zewnętrznej) są najsłabiej związane z atomem.
Każdy rząd tablicy to tak zwany okresu kładu. Kolumny układu tworzą grupy. Kolejny numer okresu układu okresowego pierwiastków odpowiada wartości głównej liczby kwantowej n elektronów, które znajdują się na zewnętrznej powłoce atomu. W obrębie jednego okresu powłoka walencyjna jest zajmowana przez kolejne elektrony. Po zapełnieniu całej powłoki następuje przejście do nowego okresu i powstanie kolejnej powłoki elektronowej. Atomy występujące w tych samych okresach mają taką samą liczbę powłok elektronowych, a występujące w tych samych grupach mają taką samą liczbę elektronów na powłokach walencyjnych. Mają więc podobne właściwości chemiczne.
Grupy
- Metale alkaliczne (zasadowe) tworzą pierwiastki z pierwszej grupy, poza wodorem. To pierwiastki o bardzo dużej aktywności chemicznej. Reagują gwałtownie w kontakcie z wodą.
- Metale ziem alkalicznych - pierwiastki drugiej grupy, również aktywne chemicznie, jednak reagują z wodą wolniej i mniej gwałtownie.
- Metale przejściowe (kolumny od 3 do 12 z wyłączeniem lantanowców i aktynowców. Metale te są używane w przemyśle.
- Metale, półmetale i niemetale - pierwiastki kolumn od 13 do 17. Niemetale leżą w prawym trójkącie. To świetne izolatory. Metale są zgromadzone w lewym trójkącie. Świetnie przewodzą prąd. Po przekątnej znajdują się pierwiastki, które nazywamy półmetalami. Wśród nich znajdują się półprzewodniki.
- Fluorowce (halogeny) - pierwiastki z 17-stej grupy układu okresowego, dość niebezpieczne, o dużej aktywności chemicznej, o intensywnym zapachu.
- Gazy szlachetne - pierwiastki ostatniej grupy układu okresowego. Prawie nigdy nie wchodzą w związki chemiczne między sobą i innymi pierwiastkami.
- Lantanowce - metale ziem rzadkich, zaczynające się od lantanu, a kończące na lutecie. To pierwiastki o bardzo zbliżonych właściwościach chemicznych.
- Aktynowce - metale ziem rzadkich, zaczynające się od aktynu, a kończące na lorensie, pierwiastki promieniotwórcze.
Opis i budowa naszej tablicy
Na początku tego artykułu znajduje się dynamiczny układ okresowy pierwiastków. Na poszczególnych miejscach w tablicy znajdują się tylko podstawowe informacje na temat nazwy i symbolu pierwiastka, jego liczby atomowej (przed symbolem) i masy atomowej i wartościowości. Poruszając się po tablicy, podświetla się wskazywany okres i grupa dla danego pierwiastka, nad którym znajduje się wskaźnik myszy (wiersze i kolumny). Kolorami oznaczono charakter chemiczny danego pierwiastka).
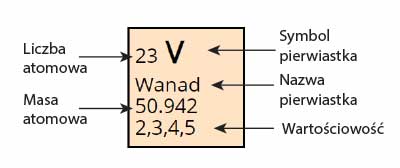
Klikając na dany pierwiastek obok tablicy (lub poniżej tablicy, jeżeli korzystasz z niższej rozdzielczości ekranu) zostaną wyświetlone szczegółowe dane o pierwiastku, w tym: wartościowość, nazwa bloku, informację czy dany pierwiastkiem jest metalem, półmetalem, czy niemetalem, stan skupienia, elektroujemność, rozmieszczenie elektronów, konfiguracja elektronowa, promień atomu, rok odkrycia, temperatura topnienia i wrzenia w kelwinach.
Ciekawostki
Nazwa "ziemie rzadkie" jest myląca. Metale ziem rzadkich nie występują wcale rzadko w przyrodzie. Problem z nimi polega na trudności wyodrębnienia tych pierwiastków. Dziś znamy metody (ekstrakcja wielostopniowa przeciwprądowa), dzięki którym otrzymanie konkretnego metalu ziem rzadkich jest dość tanie.
Pytania
Czy układ okresowy pierwiastków jest zamknięty?
Nie. Wciąż dokonujemy odkryć nowych pierwiastków, głównie sztucznie wytworzonych w laboratoriach.
Pobierz kolorowy układ okresowy pierwiastków chemicznych w formacie PDF do wydruku , klikając na powyższą grafikę.
© medianauka.pl, 2020-05-03, A-3766








