Konfiguracja elektronowa
Atomy składają się z jądra atomowego oraz krążących wokół nich elektronów. Pojęcia krążenia nie powinniśmy traktować dosłownie i analogicznie do krążenia planet wokół Słońca. Świat w mikroskali rządzi się zasadami mechaniki kwantowej, a ta pokazuje, że elektrony są niejako rozmyte wokół jądra, tworzą tak zwaną chmurę elektronową, której kształt określa prawdopodobieństwo znalezienia cząstki w konkretnym miejscu w objętości atomu.
Powłoki elektronowe
Równanie Schrödingera dla elektronu związanego w atomie (wodoru) ma tylko wówczas rozwiązanie, gdy energia elektronu przyjmuje wartości pewnej stałej wartości podzielonej przez n2. Liczba n jest nazywana główną liczbą kwantową i przyjmuje wartości 1,2,3,...
Wszystkie elektrony o zbliżonych energiach znajdują się na tak zwanych powłokach elektronowych. Oznaczamy je kolejno wielkimi literami K, L, M, N, O, P, itd. zgodnie z kolejnością alfabetyczną. Numeracja powłok odpowiada głównej liczbie kwantowej oraz numerowi okresu w układzie okresowym pierwiastków.
Powłoka K (n=1) znajduje się najbliżej jądra atomu. Elektrony na tej powłoce mają najniższą z możliwych energii i są jednocześnie najbardziej związane z jądrem (są najsilniej przyciągane). Im na wyższej powłoce znajduje się elektron, tym słabiej jest związany z atomem i tym większą energię posiada.
Na danej powłoce może się znajdować ściśle określona liczba elektronów wyrażona wzorem 2n2.
| Główna liczba kwantowa | Symbol powłoki | Maksymalna liczba elektronów |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
| 5 | O | 50 |
| 6 | P | 72 |
| 7 | Q | 98 |
Rozmieszczenie elektronów na powłokach opisujemy w taki sposób, że nad symbolem powłoki podajemy liczbę elektronów w niej występujących. Dla na przykład chloru konfiguracja elektronów na powłokach ma więc postać: K2 L8 M7 . Oznacza to, że na powłoce K znajdują się dwa elektrony, na powłoce L jest ich osiem, a w powłoce M znajduje się 7 elektronów.
Rozmieszczenie elektronów dla dowolnego pierwiastka odczytasz w naszym układzie okresowym (dostępnym w menu u góry strony).
Rozwiązując równanie Schrödingera dla atomu wodoru okazuje się, że funkcja falowa elektronu zależy od trzech liczb kwantowych: n - wyznaczającej powłoki, l - wyznaczającej tak zwane podpowłoki oraz m - wyznaczającej orbitale.
Podpowłoki elektronowe
W każdej powłoce znajdują się tak zwane podpowłoki, w których znajdują się elektrony o ściśle określonych i jednakowych energiach.
Podpowłoki oznaczamy literami s, p, d, f, g, h itd. Podpowłoka s to podpowłoka o najniższej energii.
Kolejne podpowłoki odpowiadają kolejnym numerom pobocznej liczby kwantowej l=0,1,2,....
Na danej podpowłoce może się znaleźć 2(2l+1) elektronów. Niezależnie od tego, w której powłoce znajduje się dana podpowłoka, zawsze mieści się na niej tyle samo elektronów.
Oznaczenie podpowłoki jest następujące: przed nazwą podpowłoki (s,p,d,...) podajemy numer głównej liczby kwantowej (powłoki), a w indeksie podajemy liczbę elektronów.
Przykład
Zapis 2s1 oznacza podpowłokę s (l=0) w powłoce L (n=2) z jednym tylko elektronem.
Orbitale
Orbital jest funkcją falową, która jest rozwiązaniem równania Schrödingera dla jednego elektronu, który znajduje się na jednej z powłok atomu. Można powiedzieć, że orbital opisany trzema liczbami kwantowymi określa kształt chmury elektronowej.
Konfiguracja elektronów
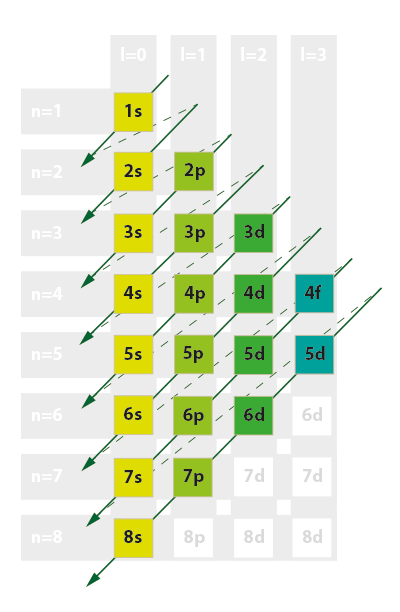
Konfigurację elektronową atomu przedstawia się przy pomocy następujących reguł:
- orbitale zapełniane są w kolejności od niższej energii 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → itd. według schematu zaprezentowanego na ilustracji obok;
- każdą podpowłokę mogą zajmować maksymalnie dwa elektrony, które zgodnie z zakazem Pauliego, muszą mieć przeciwne spiny;
- w atomie nie mogą istnieć dwa elektrony posiadające taki sam zestaw czterech liczb kwantowych: n l, ml i ms;
- zgodnie z tak zwaną regułą Hunda niezapełnione orbitale o jednakowej energii zajmowane są kolejno elektronami o takim samym spinie dopóki wszystkie wolne orbitale zostaną zajęte. Pary elektronowe na tych orbitalach pojawiają się dopiero po zapełnieniu wszystkich orbitali obsadzone przez pojedyncze elektrony.
Mamy:
| Powłoka | Symbol podpowłoki | Maksymalna liczba elektronów |
| K | 1s | 2 |
| L | 2s 2p |
2 6 |
| M | 3s 3p 3d |
2 6 10 |
Na wyższych powłokach energia elektronów zależy od głównej liczby kwantowej n, ale i w istotny sposób od pobocznej liczby kwantowej l. W związku z tym niektóre z poziomów energetycznych d czy f o niższej głównej liczbie kwantowej będą charakteryzowały się wyższą energią od poziomów o wyższej głównej liczbie kwantowej. Dlatego w przypadku niektórych pierwiastków, można zaobserwować wyjątki od „regularnego” zapełniania orbitali przez elektrony, jak np. w przypadku atomów miedzi.
Uproszczony zapis konfiguracji elektronów
Możliwy jest także tzw. skrócony zapis konfiguracji elektronowej. Jest to zapis konfiguracji, w którym przedstawia się początkowy rdzeń w postaci konfiguracji elektronowej gazu szlachetnego i uzupełnia się go o pozostałe elektrony.
Konfiguracje elektronowe wybranych pierwiastków
Konfiguracje elektronowe gazów szlachetnych.
| Konfiguracja elektronowa: | Symbol pierwiastka | Liczba atomowa | Konfiguracja pełna |
| helu | He | 2 | 1s2 |
| neonu | Ne | 10 | 1s2 2s2 2p6 |
| argonu | Ar | 18 | 1s2 2s2 2p6 3s2 3p6 |
| kryptonu | Kr | 36 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
| ksenonu | Xe | 54 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 |
| radonu | Rn | 86 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 |
Konfiguracje elektronowe najczęściej wykorzystywane.
| Konfiguracja elektronowa: | Symbol pierwiastka | Liczba atomowa | Konfiguracja pełna | Konfiguracja uproszczona |
| wodoru | H | 1 | 1s1 | - |
| litu | Li | 3 | 1s2 2s1 | - |
| węgla | C | 6 | 1s2 2s2 2p2 | - |
| tlenu | O | 8 | 1s2 2s2 2p4 | - |
| fluoru | F | 9 | 1s2 2s2 2p5 | - |
| sodu | Na | 11 | 1s2 2s2 2p6 3s1 | [Ne] 3s1 |
| krzemu | Si | 14 | 1s2 2s2 2p6 3s2 3p2 | [Ne] 3s2 3p2 |
| fosforu | P | 15 | 1s2 2s2 2p6 3s2 3p3 | [Ne] 3s2 3p3 |
| siarki | S | 16 | 1s2 2s2 2p6 3s2 3p4 | [Ne] 3s2 3p4 |
| chloru | Cl | 17 | 1s2 2s2 2p6 3s2 3p5 | [Ne] 3s2 3p5 |
| potasu | K | 19 | 1s2 2s2 2p6 3s2 3p6 4s1 | [Ar] 4s1 |
| wapnia | Ca | 20 | 1s2 2s2 2p6 3s2 3p6 4s2 | [Ar] 4s2 |
| tytanu | Ti | 22 | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | [Ar] 4s2 3d2 |
| manganu | Mn | 25 | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 | [Ar] 4s2 3d5 |
| selenu | Se | 34 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 | [Ar] 4s2 3d10 4p4 |
| bromu | Br | 35 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 | [Ar] 4s2 3d10 4p5 |
| molibdenu | Mo | 42 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 | [Kr] 5s1 4d5 |
| srebra | Ag | 47 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 | [Kr] 5s1 4d10 |
| cyny | Sn | 50 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2 | [Kr] 5s2 4d10 5p2 |
| wolframu | W | 74 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 | [Xe] 6s2 4f14 5d4 |
Jeżeli w powyższej tablicy nie znalazłeś danego pierwiastka, skorzystaj z naszej interaktywnej tablicy Mendelejewa. Są tam wyszczególnione konfiguracje elektronowe wszystkich pierwiastków.
Kształt orbitali
Funkcje falowe można poglądowo przedstawić jako wykresy gęstości prawdopodobieństwa znalezienia elektronu w przestrzeni atomu. Kątowy rozkład prawdopodobieństwa to właśnie orbital. Inaczej mówiąc w ten sposób możemy zilustrować chmury elektronowe na poszczególnych poziomach energetycznych.
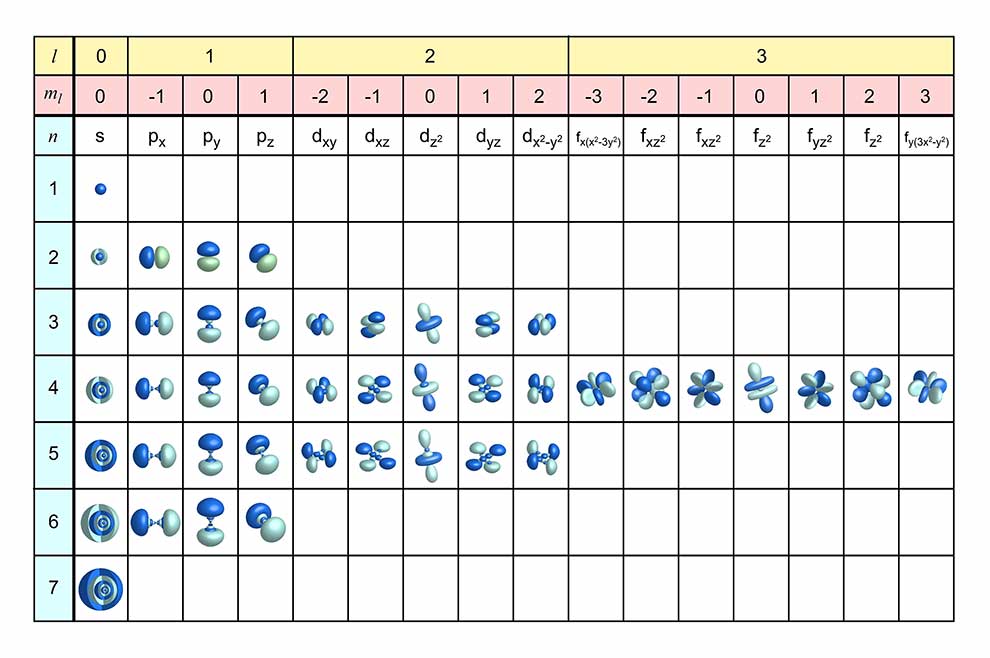
© natros - stock.adobe.com
Pobierz kolorową tablicę w formacie pdf do wydruku, klikając na powyższą grafikę.
Inne zagadnienia z tej lekcji
© medianauka.pl, 2020-05-05, A-3772


 Równanie Schrödingera
Równanie Schrödingera Dlaczego metale ziem rzadkich są podobne?
Dlaczego metale ziem rzadkich są podobne?