Druga zasada termodynamiki
Istnieje wiele sformułowań drugiej zasady termodynamiki. Oto sformułowanie z wykorzystaniem pojęcia entropii:
Wzór na drugą zasadę termodynamiki
Korzystając z powyższego sformułowania II zasady termodynamiki można napisać, że:
A oto inne sformułowania:
- W procesach rzeczywistych suma entropii układu termodynamicznego i otoczenia pozostaje bez zmian lub wzrasta.
- Nie można zbudować perpetuum mobile drugiego rodzaju.
- Silnik termodynamiczny nie może zamieniać na pracę całej ilości dostarczonego mu ciepła.
- Ciepło nie może samoistnie przechodzić z układu o temperaturze niższej do układu o temperaturze wyższej.
- Entropia jest funkcją stanu.
Druga zasada termodynamiki określa kierunek zachodzenia procesów termodynamicznych. Definiuje tak zwaną termodynamiczną strzałkę czasu.
Procesy odwracalne i nieodwracalne
Dowolny proces termodynamiczny nazywamy odwracalnym, jeżeli po jego zajściu w jedną stronę po przejściu przez te same stany pośrednie w drugą stronę układ ten wraz z otoczeniem znajdzie się w tym samym stanie. Pozostałe procesy nazywamy procesami nieodwracalnymi.
To właśnie dla procesów odwracalnych zachodzi równość w II zasadzie termodynamiki, czyli entropia układu w takim procesie pozostaje niezmienna.
Proces odwracalny zachodzi tylko wówczas, gdy układ termodynamiczny jest odizolowany od otoczenia lub jest z nim w równowadze termodynamicznej. Procesów odwracalnych nie da się w praktyce zrealizować w 100%. W procesach nieodwracalnych część energii jest rozpraszana w postaci ciepła. W procesach rzeczywistych mamy do czynienia zawsze z rozpraszaniem energii.
Przykłady
Procesy odwracalne:
- powolne sprężanie gazu w tłoku przy stałej temperaturze;
- drgania niegasnące ciała w próżni zawieszonego na idealnie sprężystej sprężynie bez udziału sił tarcia.
Procesy nieodwracalne
- proces hamowania,
- dyfuzja,
- przemiany fazowe,
- rozbicie się szklanki o podłogę,
- opadanie wody w wodospadzie,
- rozpuszczenie kryształów soli w wodzie.
Proces kwazistatyczny
Proces kwazistatyczny jest to taki proces, w którym zachodzi ciąg stanów nieskończenie bliskich stanowi równowagi termodynamicznej i między którymi zachodzi nieskończenie mała zmiana parametrów układu.
Proces samorzutny
Proces samorzutny to taki proces, który zachodzi w układzie termodynamicznym bez wykonywania pracy przez siły zewnętrzne nad tym układem.
Jeżeli proces nie wykazuje tendencji do samorzutnego zachodzenia, to taki proces nazywamy niesamorzutnym.
Ciekawostki
II zasadę termodynamiki pierwszy sformułował Rudolf Emanuel Clausius w 1865 roku. W roku 1877 Boltzmann podał jej interpretację statystyczną.

Pytania
Czy entropia może samorzutnie maleć?
Może. Tak się może stać w układzie nieizolowanym pod warunkiem, że suma entropii układu i otoczenia będzie rosła. Zatem wzrost entropii otoczenia musi w takim, przypadku wzrastać dużo bardziej niż maleć entropia układu.
Jakie ciała stałe odznaczają się niską entropią?
To ciała idealnie krystaliczne.
Czy entropia wymusza kierunek procesów termodynamicznych?
Entropia nie jest siłą. Ona jedynie mierzy efekt wywołany przez siły lub zjawiska działające w samorzutnym procesie.
Gdzie II zasada termodynamiki znajduje zastosowanie?
Przykładem niech będzie wykorzystanie paliwa, zarówno w silnikach spalinowych jak i żywności w organizmach żywych. Dzięki spalaniu zgromadzonej energii w paliwie lub pożywieniu wykorzystujemy ją do różnych celów, a w dużej mierze ją rozpraszając, zwiększając w ten sposób entropię układu.
© medianauka.pl, 2021-04-16, A-4024
Data aktualizacji artykułu: 2025-04-23

 Zerowa zasada termodynamiki
Zerowa zasada termodynamiki Trzecia zasada termodynamiki
Trzecia zasada termodynamiki Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki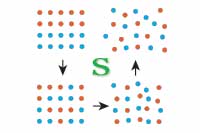 Entropia
Entropia