Równanie van der Waalsa
Równanie van der Waalsa jest równaniem stanu gazu, będące rozszerzeniem równania Clapeyrona dla gazu idealnego.
Rzeczywiste gazy nie składają się z punktów materialnych, poszczególne cząsteczki mają objętości, różne dla różnych substancji. Poza tym cząsteczki wzajemnie mogą na siebie oddziaływać, czego równanie stanu gazu idealnego nie zakłada. Te właśnie czynniki zostały uwzględnione przez van der Waalsa.
Równanie van der Waalsa ma następującą postać:
gdzie:
- \(p\) — ciśnienie,
- \(V\) — objętość,
- \(T\) — temperatura,
- \(a\) — stała charakterystyczna dla danej substancji, czynnik odpowiedzialny za oddziaływanie między cząsteczkami gazu,
- \(b\) — stała charakterystyczna dla danej substancji, uwzględniająca rozmiar cząsteczek,
- \(R\) — uniwersalna stała gazowa,
- \(n\) — liczność materii.
Stała \(a\) wprowadza poprawkę, dzięki której ciśnienie wywierane na ścianki naczynia z gazem jest nieco niższe, gdyż cząsteczki gazu wzajemnie się przyciągają między sobą. Stałe \(a\) i \(b\) wyznaczane są doświadczalnie na podstawie wzorów:
\(a=\frac{27R^2T_k^2}{64p_w}\)
\(b=\frac{RT_k}{8p_w}\)
gdzie:
- \(T_k\) — temperatura krytyczna,
- \(p_k\) — ciśnienie krytyczne.
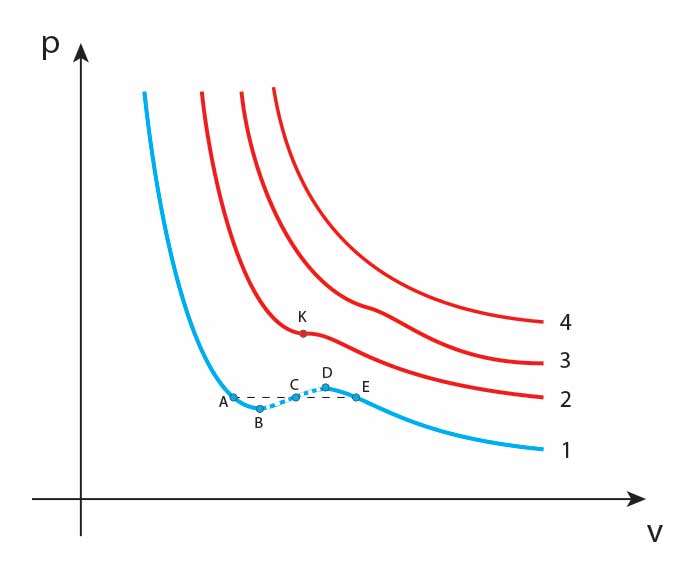
Gdy sporządzimy izotermy na podstawie równania van der Waalsa, to okazuje się, że im wyższe są temperatury gazu (kolejne numery porządkowe wykresów), tym bliżej wykresowi do izotermy gazu doskonałego. Poniżej pewnego punktu krytycznego K dzieje się jednak coś dziwnego. Przy zwiększaniu objętości gazu ciśnienie wydaje się rosnąć (fragment wykresu zaznaczono linią przerywaną). To niemożliwe. Zatem zamiast krzywej \(ABCDE\) powinniśmy mieć w tym miejscu odcinek \(AE\), a to co się w rzeczywistości dzieje z gazem to przemiana fazowa w tych warunkach. Odcinek \(AB\) reprezentuje ciecz przegrzaną, \(DE\) - parę przesyconą, \(AE\) - równowagę faz ciekłej i fazowej. Powyżej punktu K mamy do czynienia wyłącznie z fazą gazową substancji.
© medianauka.pl, 2021-05-22, A-4055
Data aktualizacji artykułu: 2023-08-09

 Równanie stanu gazu
Równanie stanu gazu