Zmiany stanu skupienia
Materia może znajdować się w kilku stanach skupienia (fazach termodynamicznych). Są to:
- gaz,
- ciecz,
- ciało stałe,
- plazma,
- kondensat Bosego-Einsteina.
Na co dzień najczęściej spotykamy się z pierwszymi trzema stanami skupienia materii, choć najpowszechniej występującym stanem we Wszechświecie jest plazma.
Stan skupienia substancji zależy od ilorazu energii kinetycznej cząsteczek i energii oddziaływań między tymi cząsteczkami. Jeżeli iloraz ten jest mały, to materia występuje w stanie stałym. Jeżeli iloraz ten z jakiegoś powodu rośnie, to może nastąpić zmiana stanu skupienia, będącą tak zwanym przejściem fazowym.
Wyróżniamy następujące zmiany stanu skupienia:
- krzepnięcie - przejście ze stanu ciekłego do stałego,
- topnienie - przejście ze stanu stałego do ciekłego,
- parowanie - przejście ze stanu ciekłego do lotnego,
- skraplanie - przejście ze stanu gazowego do ciekłego,
- sublimacja - przejście ze stanu stałego do gazowego,
- resublimacja - przejście ze stanu lotnego od razu do stałego, z pominięciem fazy ciekłej.
Powyższe zmiany stanu skupienia zostały ujęte na schemacie.
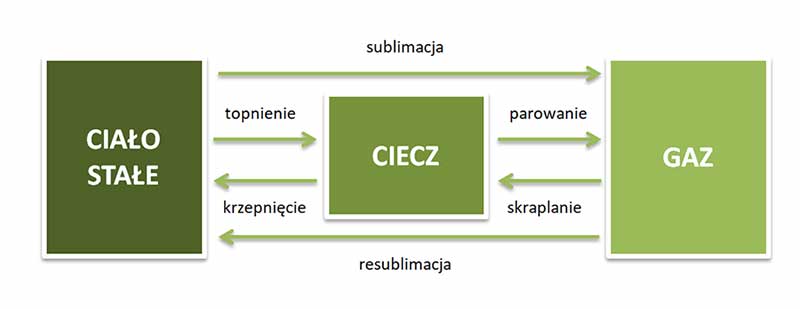
Krzepniecie lub topnienie danej substancji (krystalicznej) przy danym ciśnieniu zachodzą w tej samej temperaturze. Parowanie lub skraplanie zachodzi przy różnej temperaturze. Natomiast wrzenie, czyli gwałtowne parowanie, które zachodzi w całej objętości cieczy, zachodzi również w ściśle określonej wartości temperatury przy danym ciśnieniu.
Zmiany stanu skupienia wody
Woda w stanie stałym, czyli lód przy ciśnieniu atmosferycznym 1 atm = 101 325 Pa topi się w temperaturze 0°C. Wrzenie wody w tych warunkach zachodzi zaś w temperaturze 100°C.
Wykres równowagi fazowej
Faza ciała zależy od ciśnienia i temperatury, w jakich się znajduje. Dla różnych substancji sporządza się tak zwane wykresy równowagi fazowej. W układzie współrzędnych zależności p(T) sporządza się trzy wykresy:
- krzywą zależności pomiędzy ciśnieniem a temperaturą topnienia;
- krzywą zależności ciśnienia gazu nad powierzchnią cieczy od temperatury;
- krzywą zależności ciśnienia gazu nad powierzchnią ciała stałego od temperatury.
Wszystkie punkty które leżą na tych krzywych opisują stan równowagi fazowej. Oznacza to, że w tak określonym ciśnieniu i temperaturze ciało może się znajdować w dwóch fazach. Punkt przecięcia się trzech krzywych wskazuje na stan równowagi trzech faz. Jest to tak zwany punkt potrójny. W punkcie potrójnym jednocześnie może występować gaz, ciecz i ciało stałe.
Taki diagram fazowy wygląda schematycznie następująco:
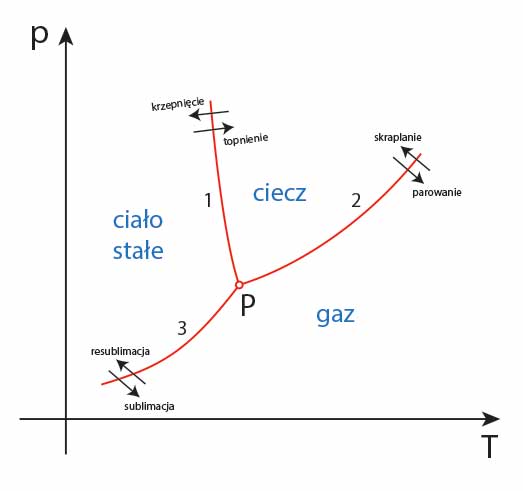
Punkt potrójny wody
Punkt potrójny wody to punkt, określony przez parametr ciśnienia i temperatury, w którym woda może występować w stanie pary wodnej, lodu i wody jednocześnie.
Woda w stanie ciekłym, lód i para wodna są w równowadze termodynamicznej (punkt potrójny wody) w temperaturze T=0,01 °C (273,16 K) i ciśnieniu p=611,66 Pa. Temperatura punktu potrójnego wody wyznaczana przy swobodnym dostępie powietrza atmosferycznego wynosi 0 °C.
Ciekawostki
Punkt potrójny wody został użyty przy definiowaniu bezwzględnej jednostki temperatury - 273,16 K (kelwina).
Wykresy równowagi fazowej można sporządzić dla dowolnego ciała i nie zawsze dotyczy on tylko wspomnianych stanów skupienia. Można także sporządzać wykres równowagi fazowej dla różnych faz stanu stałego, dla przykładu diamentu i grafitu.

Pytania
Czy w górach woda wrze w niższej temperaturze?
Tak. Temperatura wrzenia obniża się wraz ze zmniejszaniem się ciśnienia. Wysoko w górach ciśnienie, jakie wywiera na wodę atmosfera jest dużo niższe i przez to woda zagotuje się szybciej.
Czy węgiel może występować w fazie płynnej?
Tak.
Czy diagram fazowy zawsze ma trzy krzywe?
Nie. Jeżeli dane ciało ma więcej faz, krzywych na wykresie będzie tyle ile jest faz termodynamicznych tej substancji. Odpowiednio więcej tez będzie punktów potrójnych.
Czy wszystkie substance posiadająpunkt potrójny?
Nie.
© medianauka.pl, 2021-05-01, A-4044

 Stany skupienia
Stany skupienia