Krzepnięcie
Krzepnięcie jest termodynamicznym procesem przechodzenia materii ze stanu ciekłego w stan stały.
Dla substancji krystalicznych proces ten zachodzi w określonej, charakterystycznej dla danej substancji temperaturze, przy stałym ciśnieniu. To tak zwana temperatura krzepnięcia. Jest ona taka sama jak temperatura topnienia danej substancji.
Temperatura krzepnięcia wody
Temperatura krzepnięcia wody przy ciśnieniu równym 1 atm = 101 325 Pa wynosi 0°C. W takiej samej temperaturze lód topi się. Temperatura ta przy określonym ciśnieniu stanowi temperaturę równowagi fazowej, w której faza stała i ciekła mogą istnieć jednocześnie.
Ciepło krzepnięcia
Proces krzepnięcia zachodzi pod warunkiem przepływu energii w postaci ciepła.
Ciepło krzepnięcia (topnienia) jest to iloraz ciepła \(Q\) potrzebnego do zmiany cieczy w ciało stałe (lub ciała stałego w ciecz) o tej samej temperaturze do tej masy \(m\).
gdzie:
- \(Q\) - dostarczane (lub oddawane) ciepło,
- \(m\) - masa ciała,
- \(c_t\) - ciepło krzepnięcia lub topnienia.
Jednostką ciepła krzepnięcia (topnienia) jest J/kg.
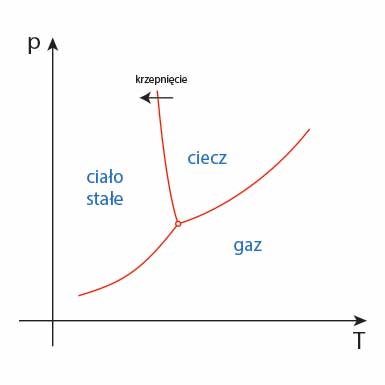
Krzepnięcie na diagramie fazowym
Proces krzepnięcia uwidaczniamy na schematycznym diagramie fazowym za pomocą strzałki.
Ciecz przechłodzona
Rozpoczęcie krzepnięcia jest uzależnione od obecności w cieczy tak zwanych zarodków krystalizacji, na których rozpoczyna się proces tworzenia kryształów. To mogą być zanieczyszczenia lub już istniejące kryształki. Brak takich zarodków prowadzi do tak zwanego przechłodzenia cieczy, która może osiągnąć temperaturę niższą niż temperatura krzepnięcia. Aby przechłodzić ciecz należy używać czystej chemicznie substancji, bardzo powoli obniżać jej temperaturę i nie wywoływać żadnych wstrząsów. Bez trudu można znacznie przechłodzić glicerynę i metale. Wstrząs lub pojawienie się zarodka wywołuje widowiskowy i gwałtowny proces krzepnięcia.
Krzepnięcie roztworów
W przypadku roztworów przy krzepnięciu roztworów występuje zwykle rozdzielenie na poszczególne składniki. Temperatura krzepnięcia roztworu zależy od stężenia roztworu. Temperatura, w której rozpoczyna się krzepnięcie roztworu, jest zazwyczaj niższa od temperatury krzepnięcia czystego rozpuszczalnika, a dla mieszanin cieczy niższa od temperatur krzepnięcia cieczy składowych. W ten sposób można rozdzielać lub oczyszczać substancje chemiczne.
Tablice
Oto temperatury krzepnięcia (topnienia) dla wybranych substancji:
| Substancja | Temperatura topnienia (krzepnięcia) [°C] |
|---|---|
| azot | -210 |
| cyna | 231,9 |
| deuter | -254,4 |
| etan | -183,2 |
| etanol | -114,5 |
| gliceryna | 18,18 |
| glikol | -12,3 |
| kobalt | 1495 |
| krzem | 1417 |
| kwas mrówkowy | 8,3 |
| kwas octowy | 16,63 |
| kwas siarkowy | 10,35 |
| metan | -182,4 |
| miedź | 1084,6 |
| mocznik | 135 |
| ołów | 327,5 |
| platyna | 1770 |
| pluton | 640 |
| rtęć | -38,83 |
| siarka | 119,6 |
| srebro | 961,8 |
| tlen | -218,78 |
| węglik hafnu | 3960 |
| woda | 0 |
Podane wartości dotyczą ciśnienia w warunkach normalnych (1 atm).

Pytania
Czy można doprowadzić do krzepnięcia substancji, nie zmieniając jej temperatury?
Tak. Wynika to wprost z diagramu fazowego. Można czasem tylko poprzez zmianę ciśnienia bez zmiany temperatury również wywołać proces krzepnięcia.
Czy każdą substancję można zestalić pod ciśnieniem atmosferycznym?
Nie. Ciekłego helu nie można zestalić w takich warunkach.
© medianauka.pl, 2021-05-02, A-4046
Data aktualizacji artykułu: 2025-04-23

 Topnienie
Topnienie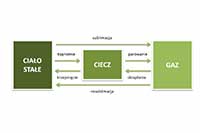 Zmiany stanu skupienia
Zmiany stanu skupienia Stany skupienia
Stany skupienia