Przemiana izotermiczna
Stan gazu określamy za pomocą trzech parametrów: \(p\), \(V\) i \(T\), czyli ciśnienia, objętości i temperatury. Parametry te mogą zmieniać się w czasie. Mówimy wówczas o przemianie stanu gazu. Jeżeli mamy do czynienia ze stałą masą gazu, to podczas przemiany zawsze zmieniają się co najmniej 2 parametry z trzech wymienionych.
Z równania Clapeyrona wynika, że:
\(pV=nRT/:T\)
\(\frac{pV}{T}=nR\)
Dla stałej masy gazu mamy więc:
Przemiana izotermiczna lub proces izotermiczny to taka przemiana gazu, podczas której temperatura \(T\) nie ulega zmianie (\(T=constans\)).
Prawo Boyle'a-Mariotte'a
Z powyższej zależności przy \(T=constans\) wynika, że:
W przemianie izotermicznej gazu doskonałego temperatura gazu nie ulega zmianie, zmieniają się natomiast ciśnienie i objętość gazu, a ich iloczyn pozostaje stały.
Przykład
Jeżeli mamy gaz zamknięty w cylindrze z tłokiem i będziemy go powoli ściskać (zmniejszać jego objętość), to automatycznie wzrośnie ciśnienie tego gazu. Jeżeli dwa razy zmniejszymy objętość, to dwa razy wzrośnie ciśnienie.
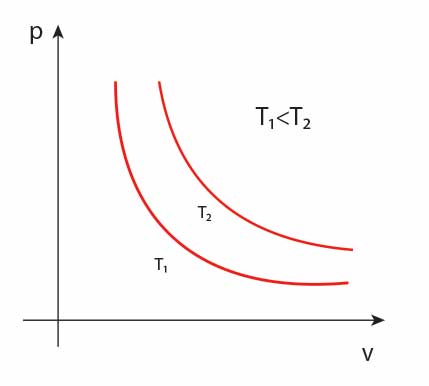
Izoterma
Ciśnienie gazu doskonałego w przemianie izotermicznej jest odwrotnie proporcjonalne do jego objętości.
Wykres zależności ciśnienia od objętości w przemianie izotermicznej to tak zwana izoterma.
Wymiana ciepła podczas przemiany izotermicznej
Zgodnie z pierwszą zasadą termodynamiki \(\Delta U=W+Q\). Podczas przemiany izotermicznej temperatura gazu nie zmienia się, nie zmienia się zatem także energia wewnętrzna gazu. Mamy więc: \(0=W+Q\).
Mimo, że temperatura gazu podczas przemiany izotermicznej nie ulega zmianie, zachodzi wymiana ciepła z otoczeniem.
Gdy mamy do czynienia z rozprężaniem gazu, gdy objętość gazu wzrasta i gaz wykonuje pewną pracę \(W\lt 0\). Wykonywana praca ma miejsce kosztem ciepła pobranego z otoczenia (\(Q\gt 0\)).
Podczas sprężania izotermicznego siły zewnętrzne wykonują pracę nad gazem (\(W\gt 0\)), zatem gaz musi oddać ciepło do otoczenia (\(Q\lt 0\)).

Pytania
Czy prawo Boyle'a-Mariotte'a obowiązuje w przypadku gazów rzeczywistych?
Obowiązuje z dobrym przybliżeniem, tym lepszym, im mniejsza jest gęstość gazu.
Ponadto ważne jest, aby proces izotermiczny w warunkach rzeczywistych zachodził bardzo wolno. Jest to konieczne, aby układ nadążał z wymianą ciepła z otoczeniem.
© medianauka.pl, 2021-04-20, A-4027
Data aktualizacji artykułu: 2025-04-23





