Skraplanie
Skraplanie jest termodynamicznym procesem przechodzenia materii ze stanu gazowego w stan ciekły. Inna nazwa dla tego procesu to kondensacja.
Dla substancji proces ten zachodzi w różnych temperaturach.
Procesowy skraplania towarzyszy wydzielanie ciepła. Proces skraplania pary może zachodzić przez jej sprężanie izotermiczne, chłodzenie pod stałym ciśnieniem lub rozprężanie.
Punkt rosy
Punkt rosy jest to zestaw parametrów temperatury i ciśnienia, dla których rozpoczyna się proces skraplania gazu.
Punkt krytyczny
Skraplanie gazu może zachodzić jedynie w temperaturze niższej od jego temperatury krytycznej. W warunkach powyżej temperatury krytycznej nie można już skroplić gazu, nawet ponosząc znacznie ciśnienie.
Punkt krytyczny jest cechą charakterystyczną danej substancji
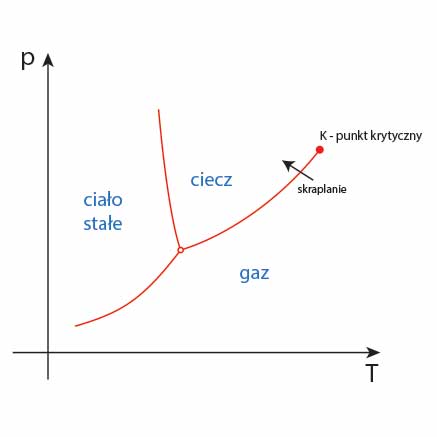
Skraplanie na diagramie fazowym
Proces skraplania uwidaczniamy na schematycznym diagramie fazowym za pomocą strzałki.
Tablice
Oto temperatury i ciśnienia krytyczne dla wybranych substancji:
| Substancja | Ciśnienie krytyczne [MPa] | Temperatura krytyczna [K] |
|---|---|---|
| hel | 0,23 | 5,2 |
| wodór | 1,3 | 33,2 |
| azot | 3,4 | 126,2 |
| powietrze | 3,77 | 132,4 |
| butan | 3,8 | 425,2 |
| tlen | 5,04 | 154,6 |
| propan | 4,25 | 370 |
| metan | 4,59 | 190,56 |
| CO2 | 7,38 | 304,2 |
| woda (para wodna) | 22,1 | 647,2 |
| rtęć | 166,1 | 1460 |
Para przesycona
Skraplanie gazu zachodzi w warunkach, w których występują ośrodki kondensacji (cząstki zawiesin, pył, jony itp.), ułatwiające utrzymanie się cząstek cieczy w pierwszej fazie ich powstawania; gdy brak jest ośrodków kondensacji, powstaje para przesycona, czyli gaz o temperaturze niższej niż wynosi temperatura skraplania przy danej wartości ciśnienia.

Pytania
Gdzie można spotkać gaz przesycony?
Bardzo często mamy do czynienia z tym zjawiskiem. Para wodna przesycona pojawia się podczas formowania cię chmur na niebie.
© medianauka.pl, 2021-05-16, A-4050

 Skąd wziąć wodę na pustyni?
Skąd wziąć wodę na pustyni? Parowanie
Parowanie Zmiany stanu skupienia
Zmiany stanu skupienia Stany skupienia
Stany skupienia